Lösungen: Moleküle
zurück zu den Aufgaben (Moleküle)
1. Es sind elektrisch neutrale Teilchen aus zwei oder mehr gleich- oder ungleichartigen Nichtmetallatomen. Dabei werden die Atome durch Atombindungen (oder Elektronenpaarbindungen) zusammengehalten.
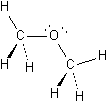
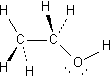
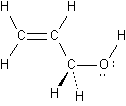
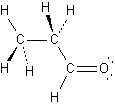
2.
|
a.
|
b.
|
|
|
c.
|
d.
|
|
|
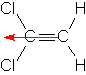
e. z.B.
|
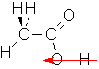
f. z.B. (Es gibt noch viel mehr Möglichkeiten)
|
|
|
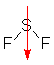
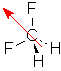
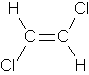
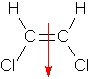
g. Anmerkung zum Dipol: Das Molekül ist nicht eben, sondern leicht verdrillt. Daher heben sich die Polaritäten der Bindungen nicht auf.
|
h.
|
|
|
i.
|
k.
|
|
3.
|
a.
|
b. z.B. (Es gibt noch andere Möglichkeiten)
|
4. Experimentelle Messungen zeigen, dass eine C,C-Einfachbindung länger und schwächer als eine C,C-Doppelbindung ist. Diese wiederum ist länger und schwächer als eine C,C-Dreifachbindung.
Die Bindungsenthalpie oder Bindungsenergie muss aufgewendet werden, um eine Atombindung vollständig zu brechen. Um eine Einfachbindung zu trennen, braucht es weniger Energie als bei einer Doppel- bzw. bei einer Dreifachbindung. Die Bindungslänge wächst im allgemeinen mit abnehmender Bindungsenthalpie.
Vereinfacht kann dies folgendermassen erklärt werden. Eine Doppelbindung ist stärker als die Einfachbindung, da sie doppelt soviele Elektronen umfasst. Die grössere Elektronenzahl ergibt eine grössere negative Ladung und damit eine stärkere Anziehung zwischen den beiden positiv geladenen Kernen. Diese stärkere Anziehung ergibt einen kleineren Abstand und die höhere Bindungsenergie.
5. Die Siedepunkte steigen in der folgenden Tabelle von Helium (He) nach Tetrabromkohlenstoff (CBr4). Es sind jeweils auch die experimentell bestimmten Siedepunkte angegeben. Diese sind experimentell bestimmt worden. Sie können nicht berechnet werden.
|
Formel |
Siedepkt. |
Begründung |
|
He |
- 269 o |
Zwischen den Helium-Edelgasatomen wirken nur sehr schwache Van-der-Waals-Kräfte (= VdWK). Diese sind wegen der kleinen Oberfläche und der geringen Elektronenzahl (2 e-) pro He-Atom sehr schwach. |
|
N2 |
- 196 o |
Die VdWK sind die einzigen zwischenmolekularen Kräfte bei den Stickstoffmolekülen. Wegen der grösseren Oberfläche und der höheren Elektronenzahl (14 e-) als bei He hat N2 den höheren Siedepunkt. |
|
HCl |
- 85 o |
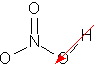
Bei den HCl-Molekülen tritt neben den VdWK (18 e-) noch eine Dipol-Dipol-Kraft auf. Diese hat die höhere Siedetemperatur zur Folge. |
|
H2O |
100 o |
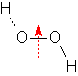
Hier wirkt sich vor allem die Wasserstoffbrücke aus. Die VdWK (10 e-) sind etwa gleich wie beim HCl bzw. wie beim N2. Die H‑Brücken aber erzeugen einen bedeutend höheren Siedepunkt. |
|
CBr4 |
190 o |
Da diese Teilchen keinen Dipol haben, wirken nur die VdWK. Die relativ grosse Elektronenzahl (146 e- im Gegensatz zu 10 e- des Wassers) hat eine sehr starke VdWK zur Folge, welche die Wasserstoffbrücken des Wassers überwiegt. |
6. Wasser mischt sich sehr gut mit Stoffen, die aus ausgeprägten Dipolmolekülen aufgebaut sind. Da die HCl-Moleküle stark polar sind, kommt es zu einer Anziehung mit den H2O-Molekülen und damit zu einer Auflösung im Wasser. Stickstoff (N2) und Sauerstoff (O2) hingegen sind unpolar und mischen sich daher nicht mit dem Wasser. Es entsteht keine Wechselwirkung zwischen N2 bzw. O2 einerseits und H2O andererseits.
7. Gefriert das Wasser in der Flasche, so dehnt es sich aus und bewirkt ein Bersten des Behältnisses. Diese Erscheinung wird folgendermassen erklärt. Beim Erstarren des Wassers entsteht ein Eisgitter mit Hohlräumen. Diese haben eine Ausdehnung der Substanz und eine Abnahme der Dichte zur Folge. Schmilzt die Substanz, so bricht die Struktur zusammen und die "Löcher" werden wieder mit Wassermolekülen ausgefüllt. Die Ursache für die besondere Anordnung sind die Wasserstoffbrücken. Nur bei der beschriebenen Struktur mit Hohlräumen können sich diese Wasserstoffbrücken optimal ausbilden.