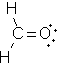
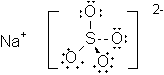
Lösungen: Ionen
zurück zu den Aufgaben (Ionen)
1.
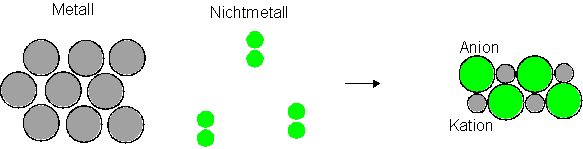
Elementare Nichtmetalle bilden Moleküle, z.B. zweiatomige Moleküle. Die Metalle hingegen ein Metallgitter. Dies erlaubt einmal die Unterscheidung von Metalle und Nichtmetallen. Das Metall bildet Kationen durch die Abgabe der Valenzelektronen, die Nichtmetalle nehmen diese auf. Dadurch schrumpft der Radius des Metalls. Das entstehende Kation hat einen deutlich geringeren Durchmesser, da nun die Valenzschale fehlt. Das Nichtmetallteilchen (= Anion) wird vergrössert, da sich nun in der Valenzschale ein zusätzliches Elektron befindet. Elektronen stossen sich wegen der negativen Ladung ab. Die Valenzschale wird merklich grösser.
2. Das Ozeanwasser enthält pro Liter etwa 40 g gelöste Salze. Diese Konzentration ist bedeutend grösser als bei der Körperflüssigkeit. Wird über längere Zeit nur noch Meerwasser getrunken, so wird das osmotische Gleichgewicht der Körperflüssigkeiten gestört. Der zu grosse Salzgehalt führt zu einem Austrocknen der Zellen und damit zum Tod.
3.
|
a. Calciumfluorid |
b. Eisen(III)-bromid (Die Ionenladung des Eisens muss mit einer römischen Zahl angegeben werden) |
|
c. Kaliumcarbonat |
d. Aluminiumnitrat |
4.
|
a. Al2(SO4)3 |
b. HNO3 |
|
c.
Na2O |
d.
Al4C3 |
|
e.
Fe(CH3COO)2 |
f.
Ca(H2PO4)2 |
5.
|
a.
|
b.
|
|
c.
|
d.
|
Bemerkung des Webmasters: Das verwendete Formelzeichnungsprogramm stellt die Elektronenpaare (leider) als Doppelpunkte und nicht als Striche dar.
Die Stoffe a, c und d sind aus Metallen und Nichtmetallen aufgebaut. Daher sind die Bausteine Ionen. Es wurden nur die einzelnen Ionen angegeben. Auf einen Ladungsausgleich wurde verzichtet.
6. Die Atomradien nehmen innerhalb einer Gruppe des Periodensystems von oben nach unten zu. Bei jeder neuen Periode kommt wieder eine neue Elektronenschale dazu. Diese bewirkt einen grösseren Durchmesser.
Innerhalb einer Periode nehmen hingegen die Atomradien im allgemeinen ab. Die Zahl der Elektronenschalen bleibt in einer Periode gleich. Die Rumpfladung hingegen nimmt zu. Dadurch wird die Valenzschale stärker angezogen und der Durchmesser wird kleiner.
7. a. Beide Teilchen haben die gleiche Elektronenzahl und damit auch die gleiche Elektronenverteilung (Anzahl und Art der besetzten Elektronenwolken). Hingegen hat das F--Ion die kleinere Kernladung als ein Na+-Ion und damit den grösseren Durchmesser.
b. Beide Teilchen haben die gleiche Kernladung. Das F--Ion hingegen hat eine grössere Elektronenzahl und damit den grösseren Radius wegen der zusätzlichen Abstossung zwischen den Elektronen.
8.
|
Schmelzpunkt (oC) |
Begründung |
|
H2 - 260 |
Es wirken nur sehr schwache Van-der-Waals-Kräfte. Das Molekül hat nur wenige Elektronen, nämlich 2. |
|
CH4 - 182 |
Diese Substanz hat den höheren Schmelzpunkt als Wasserstoff. Wegen der grösseren Gesamtelektronenzahl ist auch die Van-der-Waals-Kraft stärker. |
|
H2O 0 |
Wasser hat etwa die gleichen Van-der-Waals-Kräfte wie CH4. Es kann aber Wasserstoffbrücken ausbilden. Diese haben den bedeutend höheren Schmelzpunkt zur Folge. |
|
S8 114 |
Ein S8-Molekül hat viel mehr Elektronen (126 Elektronen) als ein Wasserteilchen. Daher wirken zwischen den Schwefel-Molekülen starke Van-der-Waals-Kräfte. Diese sind sogar stärker als die Wasserstoffbrücken des Wassers. Als ganz grobe Faustregel kann gesagt werden, dass etwa 50 Elektronen eine Van-der-Waals-Kraft ergeben die einer Wasserstoffbrücke entspricht. |
Um salzartig gebaute Materie zu schmelzen, braucht es im allgemeinen mehr Energie als bei den molekular gebauten Stoffen. Zwischen den Ionen wirken stärkere Kräfte (ganze Elementarladungen!) als zwischen den Molekülen
|
LiF 848 |
Dieses Salz hat den tieferen Schmelzpunkt wegen der kleineren Ionenladung (+/-). |
|
MgO 2800 |
Beide Ionen sind doppelt so stark geladen (2+/2-) wie die von LiF. |
9.
|
NaCl-Schmelze (geschmolzenes Salz) Leiter 2. Ordnung Ladungsträger: bewegliche Ionen chemische Veränderungen an den Elektroden durch den Strom. Leitfähigkeit nimmt mit höherer Temperatur zu. |
festes Natrium (festes Metall) Leiter 1. Ordnung Ladungsträger: Elektronengas keine chemischen Veränderungen durch die Stromleitung. Leitfähigkeit nimmt mit höherer Temperatur ab. |
10. Negative Ionen sind das Sulfat- (Molmasse 96,0 g), das Hydrogencarbonat- (61 g), das Chlorid- (35,5 g) und das Fluorid-Ion (19,0 g). Positive Ionen sind das Calcium- (40,1 g), das Magnesium- (24,3 g) und das Natrium-Ion (23,0 g). Bei der Berechnung der molaren Menge der Ladungen ist zu berücksichtigen, dass gewisse Ionnen doppelt geladen sind. Daher der Faktor "2" bei der Berechnung.
a. n (- Ladungen): 1,630*2/96,0 + 0,281/61 + 0,0018/35,5 + 0,0018/19,0 = 0,0387 mol
b. n (+ Ladungen): 0,555*2/40,1 + 0,127*2/24,3 + 0,0029/23,0 = 0,0383 mol
c. Die Ladungsmengen sollten identisch sein, da sich in einer Lösung die positiven und die negativen Ladungen der Ionen aufheben müssen. Dies ist hier mehr oder weniger der Fall. Die kleine Abweichung (1 %) ergibt sich einerseits durch Ungenauigkeit der experimentellen Ionenanalyse, andererseits sind nicht alle Ionen aufgeführt.