Lösungen: Säuren und Basen I
zurück zu den Aufgaben (Säuren und Basen I)
1.
|
konj. Säure |
Teilchen |
konj. Base |
Ampholyt |
|
HCN |
CN- |
- |
|
|
H3O+ |
H2O |
OH- |
A |
|
H2SO4 |
HSO4- |
SO42- |
A |
|
H2S |
HS- |
S2- |
A |
|
H2PO4- |
HPO42- |
PO43- |
A |
Na+ ist weder eine Säure noch eine Base und hat daher auch keine konjugierte Säure oder Base.
2.
|
|
Säure |
Base |
|
Hinreaktion |
H2SO4 |
Cl- |
|
Rückreaktion |
HCl |
HSO4- |
3. Im reinen Wasser gilt: c(H3O+) = c(OH-) = 10-7 mol/L.
Die Wasserkonzentration berechnet sich wie folgt:
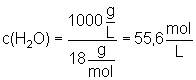
Verhältnis c(H2O) : c(H3O+) = 55,6/10-7 = 5,56.108
Da die Wasserkonzentration 556 Millionen mal grösser ist als die Hydroniumionen-Konzentration, kommen auf ein H3O+-Ion 556 Millionen Wassermoleküle.
4. Die elektrische Leitfähigkeit des reinen Wassers entsteht durch die Autoprotolyse gemäss der folgenden Gleichung:
H2O
![]() OH-(aq)+
H+(aq) , DH
> 0 (Enthalpie-Tabelle)
OH-(aq)+
H+(aq) , DH
> 0 (Enthalpie-Tabelle)
Bei einer Temperatur-Erhöhung wird gemäss dem Prinzip von Le Châtelier die endotherme Reaktion begünstigt. In diesem speziellen Fall ist das eine Verschiebung gegen rechts. Es bilden sich demzufolge mehr Ionen und die Leitfähigkeit nimmt zu.
5. Durch die Autoprotolyse des Wassers bilden sich gemäss der folgenden Gleichung gleichviele Hydroxid- und Hydroniumionen.
H2O + H2O
![]() 1
OH-(aq)+ 1
H3O+(aq)
1
OH-(aq)+ 1
H3O+(aq)
Daher ist im reinen Wasser die Konzentration der Hydronium- und Hydroxid-Ionen gleich gross, nämlich 10-7 mol/L. Der pH-Wert ist nun der negative dekadische Logarithmus der Konzentration, nämlich 7 (= -log 10-7). Es wird die Logarithmusfunktion gewählt, da die Grössenordnung der Konzentration meistens wichtiger ist als der absolute Wert. Der negative Wert wird genommen, da sonst alle pH-Werte negativ wären.
6. NH3 ist ein Ampholyt und kann daher sowohl als Säure wie auch als Base reagieren. Der pKb-Wert (= 4,75) von Ammoniak ist kleiner als der pKs-Wert (ca. 23). Demzufolge ist diese Substanz sowohl eine schwache Säure wie auch eine schwache Base. Aber die Fähigkeit als Base zu wirken ist trotzdem noch bedeutend stärker als die Säurefunktion, da der pKb-Wert kleiner ist. Folglich wird der pH-Wert zwischen 7 und 14 liegen.
7. pKb (H2O) = pKs (H2O) = 15,74. Die beiden Werte sind identisch. Wasser ist das Bezugssystem der verwendeten pK-Werte. Bei der Bestimmung der Säure- und der Basenstärke wird immer Wasser als Bezugssystem verwendet. Der pKs beschreibt die Fähigkeit einer Verbindung, an Wassermolekülen Protonen abzugeben, der pKb die Fähigkeit einer Verbindung, von Wasser Protonen aufzunehmen. Da im hier beschriebenen Fall, die Säure- und die Basenstärke von Wasser beschrieben wird, ist Wasser sowohl die zu prüfende Substanz wie auch das Bezugssystem. Der pKb und der pKs von Wasser beschreiben demzufolge die gleiche Reaktion und müssen identisch sein.
Säurestärke: H2O
+ H2O
![]() OH-+ H3O+
OH-+ H3O+
Basenstärke: H2O + H2O
![]() H3O+
+ OH-
H3O+
+ OH-
8a. Kalk wird aufgelöst. Es entsteht eine homogene Lösung
CO2(g)
+ H2O(l)
+ CaCO3(s)
![]() Ca2+(aq) + 2 HCO3-(aq)
Ca2+(aq) + 2 HCO3-(aq)
b. Es bildet sich H2S-Gas. In einem solchen Fall können Gasbläschen beobachtet werden. Dieses Gas riecht intensiv nach faulen Eiern.
2
Na+(aq)
+ S2-(aq)
+ 2 HCOOH(l)
![]() 2 Na+(aq) + 2 HCOO-(aq)
+ H2S(g)
2 Na+(aq) + 2 HCOO-(aq)
+ H2S(g)
c. Aus den beiden Gasen
entsteht festes NH4Cl:
HCl(g) + NH3(g)
![]() NH4Cl(s)
NH4Cl(s)
d. Es kann vermutlich keine Veränderung beobachtet werden. Höchstens eine fast nicht wahrnehmbare Ammoniakbildung entsteht.
2
Na+(aq) + CO32-(aq) + NH4+ + Cl-
![]() 2
Na+(aq) + HCO3-(aq) + NH3(g)
+ Cl-(aq)
2
Na+(aq) + HCO3-(aq) + NH3(g)
+ Cl-(aq)
9. Die Salzsäure wandelt das Carbonation in Kohlensäure um. Diese zerfällt in Wasser und Kohlendioxidgas. Dieses entweicht und verursacht die Gasbläschen.
2
H3O+(aq) + 2 Cl-(aq) + CaCO3(s)
![]() Ca2+(aq) + 2 Cl-(aq) + CO2(g)
+ 3 H2O(l)
Ca2+(aq) + 2 Cl-(aq) + CO2(g)
+ 3 H2O(l)
10. Gemäss den Säurenstärken liegt das Gleichgewicht links. Die Reaktionsenthalpie kann mit einer Tabelle der Bildungsenthalpien berechnet werden. Durch die Temperatuerhöhung wird aber die endotherme Reaktion begünstigt. Das Gleichgewicht verschiebt sich dadurch gegen rechts. Weiter ist das entstehende Kohlenstoffdioxid gasförmig und entweicht. Dies bewirkt zusätzlich eine Verschiebung gegen rechts.
2
NH4+(aq)
+ CO32-(aq)
![]() 2
NH3(g) + CO2(g)
+ H2O(l), DH
> 0
2
NH3(g) + CO2(g)
+ H2O(l), DH
> 0