Lösungen: Einführung org. Chemie, Alkane
zurück zu den Aufgaben (Einführung org. Chemie, Alkane)
1.
|
a. Alkohol
|
b.
Carbonsäure |
c.
Aldehyd |
|
|
d. Amin
|
e. Keton
|
||
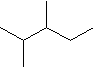
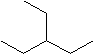
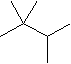
2.
![]()

![]()
![]()
3. Die beiden Strukturen stellen Konstitutionsisomere mit der Bruttoformel C4H10O dar. Die beiden Isomere "a" und "b" unterscheiden sich beispielsweise im Siedepunkt und in der Wasserlöslichkeit.
Substanz "a" (Siedepunkt 117 oC) hat den höheren Siedepunkt als Stoff "b" (Siedepunkt 35 oC). Die Van-der-Waals-Kräften sind in beiden Fällen etwa gleich, da es Isomere sind. "a" kann aber zusätzlich noch Wasserstoffbrücken ausbilden. Ebenfalls wegen der Wasserstoffbrücken ist "a" besser wasserlöslich als "b".
4.
|
a: 3-Methylpentan |
b = d = f: 3-Methylhexan |
|
c: n-Heptan |
e: 2-Methylpentan |
"a" ist zu "e" konstitutionsisomer.
"c" ist zu "b"="d"="f" konstitutionsisomer.
5.
|
n-Heptan
|
2-Methylhexan
|
3-Methylhexan
|
|
2,2-Dimethylpentan
|
2,3-Dimethylpentan
|
2,4-Dimethylpentan
|
|
3,3-Dimethylpentan
|
3-Ethylpentan
|
2,2,3-Trimethylbutan
|
6. Die Siedepunkte der molekular gebauten Stoffe sind von der Grösse der zwischenmolekularen Kräfte abhängig. Je grösser diese sind, desto höher ist der Siedepunkt. Die drei nach den Siedepunkten zu ordnenden Substanzen sind Alkane. Zwischen diesen wirken praktisch nur die Van-der-Waals-Kräfte. Diese sind von der Elektronenzahl und der Oberfläche des Teilchens abhängig.
n-Heptan hat eine CH2-Gruppe weniger als n-Octan, damit auch weniger Elektronen und damit die kleineren zwischenmolekularen Kräfte (= tieferen Siedepunkt). Die beiden anderen Stoffe sind Konstitutionsisomere und haben damit die gleiche Anzahl Elektronen. Hingegen ist 2,2,3,3-Tetramehtylbutan kugelförmiger (= kleinere Oberfläche) und hat daher die kleineren Van-der-Waals-Kräfte (= tieferen Siedepunkt) als n-Octan.
Reihenfolge der Siedepunkte: n-Heptan < 2,2,3,3-Tetramethylbutan < n-Octan
7.
|
1,1-Dibromhexan 1,2-D.... 1,3-D.... 1,4-D.... 1,5-D.... 1,6-D.... |
2,2-Dibromhexan 2,3-D.... 2,4-D.... 2,5-D.... |
3,3-Dibromhexan 3,4-D.... |
8. Beim Chemisch-Reinigen werden die Textilien mit chlorierten Kohlenwasserstoffen (z.B. C2Cl4 oder CH3CCl3) oder mit Alkanen gereinigt.
Vorteil: Die Fasern quellen nicht auf. Damit behalten die Textilien ihre Form. Viele Kleider bestehen aus Naturfasern (z.B. Baumwolle, Wolle und Seide). Diese können wegen den OH- und NH-Gruppen Wasserstoffbrücken ausbilden. Sie quellen daher im Wasser, d.h. ihre Form und Gestalt kann beim Waschen mit Wasser ändern.
Nachteil: Die beim Reinigungsprozess verwendeten chlorierten Kohlenwasserstoffe und Alkane entweichen in die Atmosphäre. Tetrachlorethen gilt als gesundheitsgefährdend. Alkane sind brennbar.
9. Die FCKW benötigen ca. 10 Jahre bis sie von der Erdoberfläche in die Stratosphäre gelangt sind. Bei einem sofortigen Anwendungsstopp werden also während dieser Zeit noch weiterhin FCKW in die Ozonschicht gelangen.
Dort spalten dann energiereiche UV-Strahlen der Sonne Chlorradikale ab.
CFCl3
![]() .CFCl2
+ Cl.
.CFCl2
+ Cl.
Diese Radikale führen zu einem katalytischen Abbau der Ozonmoleküle gemäss folgenden Gleichungen:
Cl.
+ O3
![]() ClO. +
O2
ClO. +
O2
ClO.
+ O3
![]() Cl.
+ 2 O2
Cl.
+ 2 O2
"Katalytischer Abbau" bedeutet, dass die Cl.-Radikale am Schluss wieder unverändert vorliegen. Theoretisch könnte ein einziges Cl.-Radikale die ganze Ozonschicht zerstören. Glücklicherweise werden aber mit der Zeit auch die Cl.-Radikale zerstört. Die Umwandlung in stabile und damit katalytisch unwirksame Substanzen (z.B. in HCl) erfolgt erst nach einer gewissen Zeit (mehrere Jahre). Dieser katalytische Mechanismus bewirkt einen langen Nachlaufeffekt.