Lösungen: Alkene und Alkine
zurück zu den Aufgaben (Alkene und Alkine)
1. Beim Sehvorgang findet eine (E)/(Z)-Isomerisierung statt. Doppelbindungen sind im Gegensatz zu Einfachbindungen nicht frei drehbar. Daher kann es eine (E)- oder eine (Z)-Geometrie an Doppelbindungen geben.
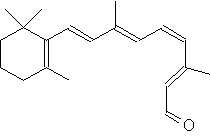
Das Sehpurpur (= Rhodopsin) besteht aus dem Retinal (= ein Derivat des Vitamins A) und einer Protein-Komponente. Eine Doppelbindung des Retinals ist in der instabileren (Z)- oder cis-Geometrie. Durch den Lichtimpuls (= Photon) wird die Aktivierungsenergie für die Isomerisierung dieser Doppelbindung in die stabilere (E)- oder trans-Form zugeführt. Die Isomerisierung ist exotherm, Energie wird dabei frei. Diese ermöglicht die Übertragung des Nervenimpulses.
Das Licht ist also die Aktivierungsenergie für einen exothermen Prozess, nämlich eine cis-trans-Isomerisierung.
Struktur von 11-(Z)-Retinal:
2. Die Strichformeln der
beiden Isomere sind
![]() und
und
![]() .
.
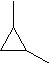
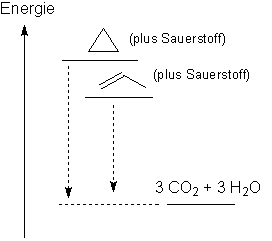
Bei Einfachbindungen müssten die Bindungswinkel 109o sein. Im gleichseitigen Dreieck (= Cyclopropan) ist der Winkel aber nur 60o. Dies führt zu einem sehr gespannten und damit energiereichen Molekül (= Ringspannung). Das offenkettige Propen hat keine Ringspannung, ist daher energieärmer.
Beide Stoffe werden beim Verbrennen zu den identischen Verbrennungsprodukten abgebaut. Also ist die Energiedifferenz vom gespannten Cyclopropan grösser. Dieses hat die grössere Verbrennungsenergie. Die Skizze veranschaulicht diesen Sachverhalt. Sie ist aber nicht massstabgerecht.
3. Ja, die beiden Siedepunkte sind verschieden. (Zwar nur leicht, aber doch messbar. Beim (Z)-Isomeren ist er 3,7o, beim anderen 0,9o.) Die Van-der-Waals-Kräfte müssen identisch sein (gleiche Elektronenzahl, gleiche Oberfläche). Aber das (Z)- weist im Gegensatz zum (E)-Isomeren einen Dipol auf, da bei diesem die Ladungsschwerpunkte zusammenfallen. Dieser Dipol bewirkt beim cis-But-2-en den höheren Siedepunkt.
4. Die Antwort ist sehr ähnlich wie bei der Aufgabe 2. Bei der Verbrennung der beiden Isomere entstehen wiederum die gleichen Mengen CO2 und Wasser. Die Verbrennungswärme wird beim (Z)-Pent-2-en betragsmässig grösser sein, da dieses instabiler ist.
5.
|
a. (E)-3-Methylpent-2-en |
b. (Z)- 3-Methylpent-2-en |
|
c. (E)-4-Butylhept-5-en-1-in |
d. (E)-Cycloocten |
|
e. (E,E)-2-Ethylhepta-1,3,5-trien
|
d. 3-Methylcyclohexa-1,4-dien |
6.
C5H10
= CnH2n.
Gemäss dieser Bruttoformel muss ein Doppelbindungsäquivalent vorhanden sein,
entweder Doppelbindung oder Ring.
|
Cyclopentan
|
Methylcyclobutan
|
|
1,1-Dimethylcyclopropan
|
1,2-Dimethylcyclopropan
|
|
Ethylcyclopropan
|
Pent-1-en
|
|
Pent-2-en
(cis oder trans)
|
3-Methylbut-1-en
|
|
2-Methylbut-1-en
|
2-Methylbut-2-en
|
7. Zum Beispiel: Cyclohexan reagiert nur langsam mit Brom und bei Aktivierung durch Licht (radikalische Substitution). Hex-1-en hingegen addiert rasch und ohne Licht Brom (elektrophile Addition). Wird zur Substanzprobe etwas Brom gegeben, so tritt bei Hex-1-en eine rasche Entfärbung der braunen Bromfarbe ein.