Säuren und Basen II (87-94)
zurück zur Kapitelübersicht
1. Liegt der pH-Wert der folgenden Lösungen im sauren, neutralen oder alkalischen Bereich (<,= oder > 7?). Begründen Sie Ihre Antwort.
|
a. Kaliumcarbonat |
b. Natriumdihydrogenphosphat |
|
c. Natriumhydrogenphosphat |
d. Natriumchlorid |
|
e. Eisen(III)-nitrat |
f. Ammoniumchlorid |
2. Berechnen Sie jeweils den pH-Wert der folgenden wässrigen Lösungen.
|
a.
0,001 mol/L HBr |
b.
0,001 mol/L CH3COOH |
|
c.
0,0002 mol/L NaOH |
d.
0,000000001 mol/L HCl |
3. Damit Trinkwasser die Wasserleitungen nicht korrodiert, soll es einen pH-Wert von 8,5 aufweisen und wird daher mit Natriumhydroxid versetzt. Wieviele Gramm festes Natriumhydroxid muss theoretisch 100 m3 Quellwasser zugeben werden, damit der pH-Wert 8,5 beträgt? Annahme: Quellwasser sei reines Wasser.
4. 1 Liter einer 0,12 mol/L HCl-Lösung und 1 Liter einer 0,08 mol/L NaOH werden vereinigt und gut vermischt. Welche Reaktion läuft dabei ab? Wie gross ist der pH-Wert dieser Mischung?
5. Nehmen Sie an, ein bestimmtes Blut enthalte als Puffersubstanzen nur H2CO3 und HCO3--Ionen.
a. Der pH-Wert des Blutes sei 7,7. Wie gross ist die Konzentration von H2CO3, wenn die HCO3--Konzentration 23 mmol/L ist?
b. Wie ändert der pH-Wert (DpH?), wenn dieses Blut (Volumen 6 Liter) infolge starker Muskeltätigkeit 9 mmol einer (relativ starken) einprotonigen Säure aufnehmen muss?
6. Ein Liter einer Lösung (1 mol CH3COOH pro Liter reinem Wasser) wird mit 0,5 mol festem Kaliumhydroxid versetzt (keine Volumenänderung durch die KOH-Zugabe).
a. Welche Teilchen enthält dieses Gemisch nach der Reaktion der beteiligten Substanzen?
b. Welchen pH-Wert hat die entstehende Lösung?
7. Bestimmter Speiseessig enthalte pro Liter Lösung 45 g reine Essigsäure. Von diesem Speiseessig werden 50 mL mit 1 mol/L NaOH-Lösung titriert. Welches Basenvolumen wird zur Neutralisation benötigt?
8. Bestimmen Sie mit Hilfe der folgenden Titrationskurven die Konzentration und die Säurestärke von den Säuren "A" und "B". Es wurden jeweils 100 mL Säurelösung mit 0,1 mol/L NaOH-Lösung titriert.
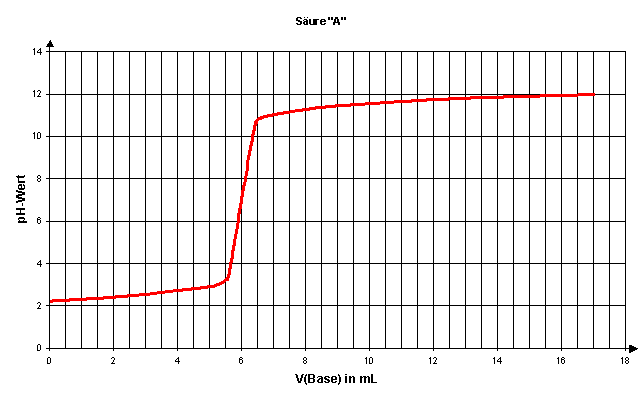
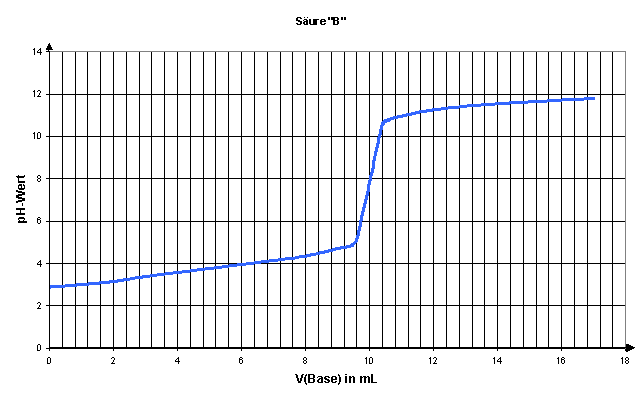
Lösungen:
Säuren und Basen II
|
Aufgaben als PDF-Dokument:
|